Antoine BRUNEL, Côme CATTIN, Camille CHARTIER
29/04/2021

L’article complet
.
Plus d’informations iodées
Saviez-vous que l’iode était un élément star d’Hollywood ?
En effet, on le retrouve dans plusieurs séries de renommées mondiales comme Tchernobyl (2019) et Breaking Bad (2008-2013). Dans la première série, l’utilisation d’iode aurait pu sauver de nombreuses vies tandis que dans la seconde, il a détruit des vies !
Mais l’iode est plus qu’un élément star d’Hollywood, c’est un élément au service de la société depuis sa découverte il y a 210 ans !
Les grandes dates de la recherche sur l’iode
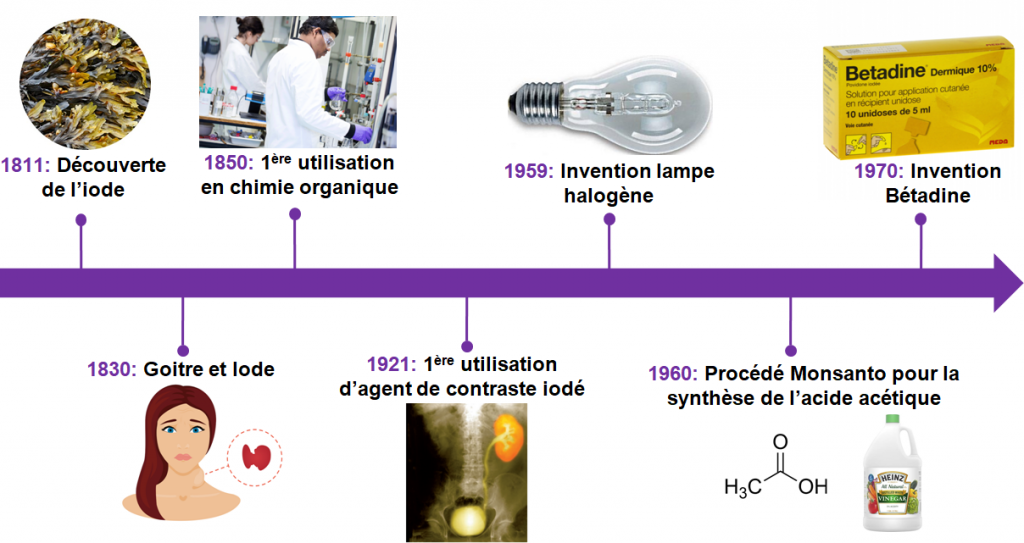
Historique de la découverte
La première indication de l’existence de l’iode remonte à 1811 lorsque le chimiste français Bernard Courtois choisit d’utiliser des cendres de varechs (des algues) pour remplacer la cendre de bois dans le processus de production du salpêtre, composé nécessaire à la création de poudre à canon. En voulant ajouter de l’acide sulfurique concentré pour enlever la matière organique des cendres, il observe la formation d’une vapeur violette. Il s’agit de l’iodure I– présent dans les algues qui s’est oxydé en diiode I2 puis sublimé. Bernard Courtois récupère ensuite des cristaux de ce composé par condensation de la vapeur formée.
En 1813, Gay-Lussac propose pour cet élément le nom « iode » issu du mot grec ioeides « couleur de la violette » pour faire référence à la couleur violette des vapeurs de diiode.
Origine sur Terre
L’iode est peu présent sur Terre avec une abondance de 0,05 ppm, ce qui le classe 47ème dans l’ordre d’abondance des éléments. Dans la nature, il se trouve à l’état d’iodure I– et d’iodate IO3– qui se combinent à des cations pour former des composés neutres.
Même si l’iode est peu abondant, il est possible de l’extraire de certains endroits du globe où sa concentration est plus élevée :
- dans les varechs (algues),
- dans les saumures (solutions aqueuses salées) au Japon et aux Etats-Unis,
- dans les gisements de phosphate de Chine,
- dans les caliches (minerais de nitrate) du Chili.
Applications au quotidien, industrielles et en laboratoire
Lampe à incandescence halogène
La lampe incandescente à halogène est composée d’un filament de tungstène avec un gaz halogène (diiode ou dibrome) à basse pression dans une petite ampoule en verre de quartz.
Dans les lampes à incandescence classique constituées d’un gaz rare et non d’un gaz halogène, il n’est pas possible d’augmenter énormément la température du filament car celui-ci va spontanément se dégrader. En effet, les atomes de tungstène libres se dirigent par convection vers l’ampoule en verre de quartz froid et se recristallise sur cette surface. Ce phénomène va finir par rompre le filament et faire noircir l’ampoule.
En utilisant un gaz halogène à la place d’un gaz rare, un nouveau phénomène a lieu : le cycle tungstène-halogène. Ce phénomène va permettre de limiter les principaux problèmes de la lampe à incandescence standard à base de gaz rare.
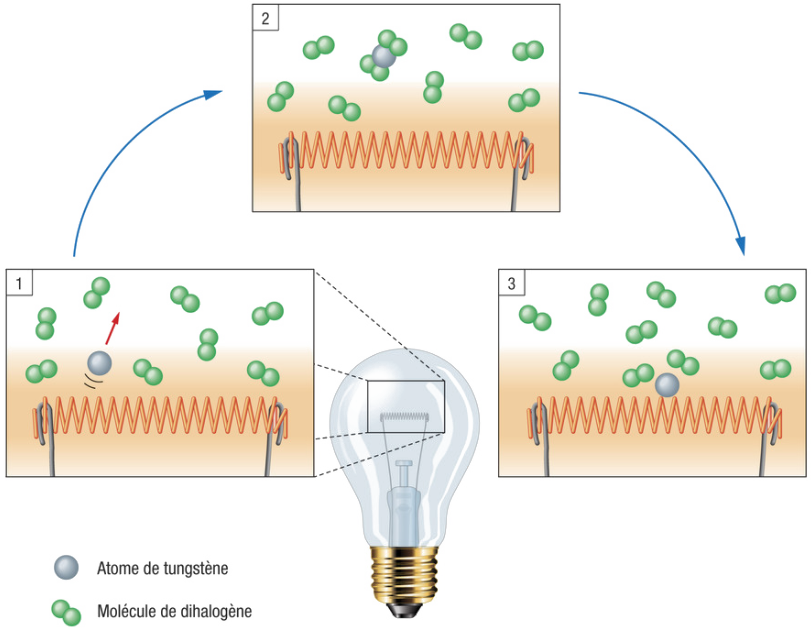
(G. Boisclair, Physique de la lumière, 2016)
Le cycle débute par le décrochage d’un atome de tungstène lors de la sublimation du filament (1) puis il y a la formation de l’halogénure de tungstène (2) qui empêche le composé de recristalliser sur la surface de l’ampoule en verre de quartz. Enfin, l’halogènure de tungstène se décompose et l’atome de tungstène se dépose sur le filament (3).
Chimie catalytique
La production industrielle d’acide acétique (4 Mt/an) est actuellement dominée par la carbonylation du méthanol (1).
CH3OH + CO = CH3COOH (1)
Les procédés industriels nécessitent un catalyseur. C’est le procédé Monsanto basé sur un complexe d’iodure de rhodium comme catalyseur qui est développé en premier à partir de 1960. Il sera remplacé en 1996 par le procédé Cativa utilisant l’iodure d’iridium.
Le changement de métal (rhodium à iridium) permet notamment d’accélérer certaines étapes de la carbonylation et de diminuer la formation d’impureté comme l’acide propanoïque. L’un des plus grands avantages du procédé Cativa est de limiter de 50 % la formation de CO2.
Chimie des solutions
L’iode joue également un rôle clé en chimie des solutions. Il est généralement utilisé pour faire des titrages, on parle de titrages par iodométrie. C’est une méthode de dosage indirect qui fait appel au couple rédox I2/I−. Le plus souvent, cette technique consiste à oxyder l’iode en diiode qui est ensuite titré par l’ion thiosulfate (couple rédox S4O62-/S2O32-) pour remonter à une quantité de matière recherchée.
• L’iodométrie peut par exemple être utilisée pour doser l’eau dans un échantillon : c’est la méthode Karl Fischer.
• L’iodométrie permet également de doser le dioxygène dissous dans de l’eau : c’est la méthode de Winkler.
Les titrages iodométriques sont facilités par la couleur que prend l’iode en solution. En présence d’ions iodures et de diiode, il y a la formation du triiodure I3– (I– + I2 = I3–), de couleur ambrée en solution aqueuse. De plus, en présence d’amidon, il se forme un complexe amidon-triiodure de teinte bleue foncée, aspect très utile pour déterminer la disparition du triiodure et déterminer précisément l’équivalence.

(https://chimieanalytique.com/)
Chimie organique
Les diverses propriétés chimiques de l’iode en font un élément très utilisé en chimie organique. Vous trouverez ci-dessous quelques exemples de réactions « originales » basées sur l’iode.
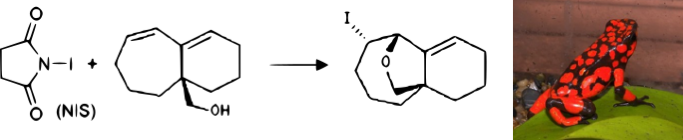
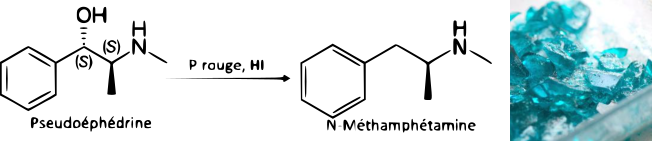
Cellules solaires de Grätzel
Les cellules solaires à pigment photosensible, autrement appelées cellules Grätzel du nom de leur inventeur, ont été développées en 1991. Depuis une dizaine d’années, elles font leur apparition sur le marché.
Leur principe de fonctionnement est décrit ci-dessous.
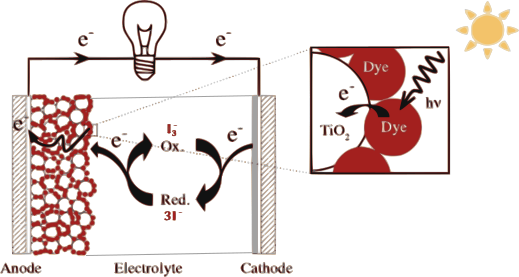
(C. Girault et al., ENSTA ParisTech, 2011)
Le couple I– / I3– est utilisé ici comme électrolyte puisqu’il permet de faire des réactions rédox rapides et il contribue à la très bonne conductivité de l’électrolyte. De plus, cet électrolyte est non volatil, stable et a un coût faible.
C’est une technologie prometteuse puisqu’elle fait intervenir des matériaux bons marchés et permet la production d’énergie verte. Elle a en plus l’avantage d’être flexible au niveau de sa conception : il est possible de créer des cellules transportables et des cellules transparentes qui ouvrent la voie à de nombreuses applications. On les retrouve notamment dans des sacs et sur des façades de bâtiment.
Applications médicales
Bétadine
L’iode et les iodophores (Un iodophore est composé d’iode complexé avec un agent solubilisant, ce composé dans l’eau libère de l’iode libre en solution.) sont des antiseptiques à large spectre d’action antimicrobienne utilisés dans le traitement et la prévention de l’infection des plaies.
L’iodophore le plus populaire est la povidone iodée commercialisée sous le nom de Bétadine. C’est un complexe entre un polymère de la povidone (PVP) et du triiodure I3–.
Ces formes ont remplacé en grande partie les teintures d’iode (antiseptiques composés de sels d’iodure dissous dans un mélange eau/éthanol) car les antiseptiques à base d’iodophore ne provoquent pas de sensation de brûlure lorsqu’elles sont appliquées sur la peau et les plaies.
Rôle dans l’organisme
L’iode est présent naturellement dans l’organisme en très faible quantités (quelques ppm). Cet élément est nécessaire à la vie de l’organisme et joue un rôle important dans ce dernier : c’est un oligo-élément.
Dans le corps humain, on retrouve surtout l’iode dans la thyroïde, une glande située sur la face antérieure du cou. Les hormones thyroïdienne sont produites dans la thyroïde à partir de la tyrosine et d’iode. Ces hormones sont essentielles à la croissance, au développement et à la différentiation des cellules dont les cellules du système nerveux central.
Un manque d’iode provoque un ralentissement de la biosynthèse des hormones thyroïdiennes conduisant à un gonflement important de la thyroïde appelé goitre. Pour des carences ou des dysfonctionnements graves de la thyroïde, des symptômes de crétinisme peuvent apparaître comme une petite taille et un retard mental. L’expression de « crétin des Alpes » vient des premières descriptions historiques du crétinisme faites dans ces régions d’endémie.

Pour palier les risques de carence en iode, l’OMS préconise un apport journalier de 150 µg d’iode grâce au sel de table iodé.
Catastrophe nucléaire
Il est recommandé aux populations en cas de catastrophe nucléaire (accident ou attaque) d’ingérer des pastille d’iodure de potassium (KI). Ces pastilles vont saturer la glande thyroïdienne en iode, empêchant les isotopes d’iode radioactifs libérés de se fixer sur la thyroïde et de répandre des radiations sur les tissues proches qui endommagent l’ADN. Des tumeurs sur la thyroïde sont ainsi évitées.
Ces pastilles doivent être consommées dans les 24 heures suivant la catastrophe pour être efficaces.
En France, les pastilles sont disponibles en pharmacie dans un rayon 20 km autour des centrales nucléaires.
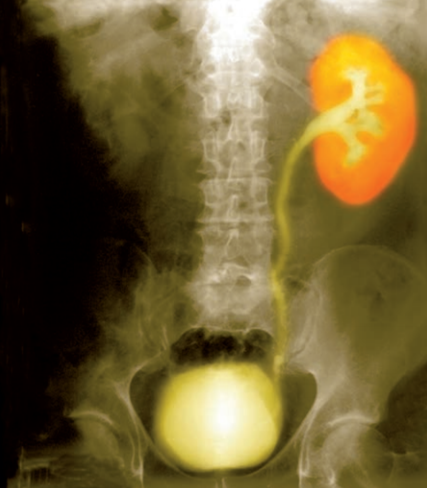
Agent de contraste lors d’examens aux rayons X
Les composés iodés sont utilisés en tant qu’agents de contraste lors d’examens aux rayons X puisqu’ils permettent d’augmenter artificiellement le contraste des images et ainsi de mieux visualiser les structures anatomiques comme le montre la radiographie du système urinaire. Ces agents de contraste iodés empêchent les rayons X de pénétrer dans les tissus puisque le noyau des atomes d’iode comporte un grand nombre d’électrons qui permet de les absorber fortement. Pour être un agent de contraste, les molécules doivent également être saines pour l’organisme, solubles dans l’eau et stables chimiquement.
Et pour terminer, voici une jolie réaction à base d’iode 🙂
Références
- « The History of Iodine – From Discovery to Commodity », Indian Journal of Chemical Technology, J. Wisniak, 2001, Vol. 8, pp. 518-526.
- « The History of Iodine in Medicine. Part I: From Discovery to Essentiality », G. Abraham, 2006.
- « Mémoire sur l’iode », Annales de Chimie, M. Gay-Lussac, 1814, Vol. 5, pp. 101-109.
- « Halogens and Noble Gases », Facts On File, M. Halka et al., 2010.
- « Iode », Techniques de l’ingénieur. Ressources marines et biotechnologies bleues, P. Blazy et al., 2009.
- « Key aspects of the iodine metabolism in brown algae: a brief critical review », Metallomics, C. Carranoet al., 2019, Vol. 11.
- « Iodine transfers in the coastal marine environment: the key role of brown algae and of their vanadium-dependent haloperoxidases », Biochimie, C. Leblanc et al., 2006, Vol. 88, pp. 1773-1785.
- « Advanced Inorganic Chemistry », Interscience Publishers, F. Cotton et al., 1999.
- « Analytical Chemistry of Organic Halogen Compounds », Pergamon Press, L. Mazor, 1975.
- « Handbook of Chemistry and Physics (93rd edition) », W. Haynes et al., CRC Press, 2013.
- « Chimie Inorganique : Théories et applications », Dunod, G. Wulfsberg, 2002.
- « Sources de lumière du XXI siècle », Techniques de l’ingénieur, G. Zissis et al., 2004.
- « Chimie industrielle », Dunod, R. Perrin et al., 1999.
- « The Cativa Process for the Manufacture Plant of Acetic Acid », Platinum Metals Review, J. Jones, Vol. 44, pp. 94-105.
- « Titrages par iodométrie », Techniques de l’ingénieur. Chimie organique et minérale, D. Baylocq-Ferrier et al., 1991.
- « Histrionicotoxin from South American Poison-Dart Frogs », The Chemical Laboratories, N. Edwards et al., consulté le 28/04/2021.
- « Palladium- or nickel-catalyzed cross coupling. A new selective method for carbon-carbon bond formation », Chemical Review, E. Negishi, 1982, Vol. 15, pp. 340-348.
- « Hypervalent Iodine Reagents for the Oxidation of Alcohols and Their Application to Complex Molecule Synthesis », Advanced Synthesis & Catalysis, H. Tohma et al., 2004, Vol. 346, pp. 111-124.
- « Recreational drug discovery: natural products as lead structures for the synthesis of smart drugs », Nat Prod Rep, G. Appendino et al., 2014, Vol. 31, pp. 880-904.
- « Iode et santé : l’ élimination sans risque des troubles dus à une carence en iode par iodation du sel, mise au point de l’ Organisation mondiale de la Santé », World Health Organization. Nutrition Unit, 1994.
- « Encyclopedia of Polymer Science and Technology (3rd edition) », Wiley, F. Herman, 2013.
- « Iodine status worldwide : WHO Global Database on Iodine Deficiency », World Health Organization, B. de Benoist et al., 2004.
- « Hormones thyroïdiennes T4 et T3 », Pharmacorama, P. Allain, consulté le 28/04/2021.
- « Hormone thyroïdienne », Wikipedia, consulté le 28/04/2021.
- « Iodine deficiency–way to go yet », The Lancet, 2008, Vol. 372., p. 88.
- « Iode, Fiche toxicologique n°207 », INRS, 2006.
- « Commemorating two centuries of iodine research: an interdisciplinary overview of current research », Angew Chem Int Ed Engl, F. Küpper et al., 2011, Vol. 50, pp. 11598-11620.
- « Agent de contraste pour l’IRM », Techniques de l’ingénieur. Chimie organique et minérale, J. Morfin et al., 2014.
- « Assessing the effectiveness of X–ray contrast media for abdominal computed tomographic examinations: comparison of four low–osmolality agents », Journal of Clinical Pharmacy and Therapeutics, L. Marti-Bonmati et al., 1995, Vol. 20, pp. 75-81.
- « Dye-Sensitized Solar Cells », Chemical Reviews, A. Hagfeldt et al., 2010, Vol. 110, pp. 6595-6663.
- Vidéo de la sublimation extraite de « Making iodine« ,Youtube ,NileRed
- Vidéo de la réaction de l’oxyde d’iode avec le fer extraite de « Iodine – The most colourful element on earth! »,Youtube ,Thoisoi2


